Lepra: Un trastorno bipolar
Palabras clave:
lepra, inmunología de la lepra, reacciones lepróticasResumen
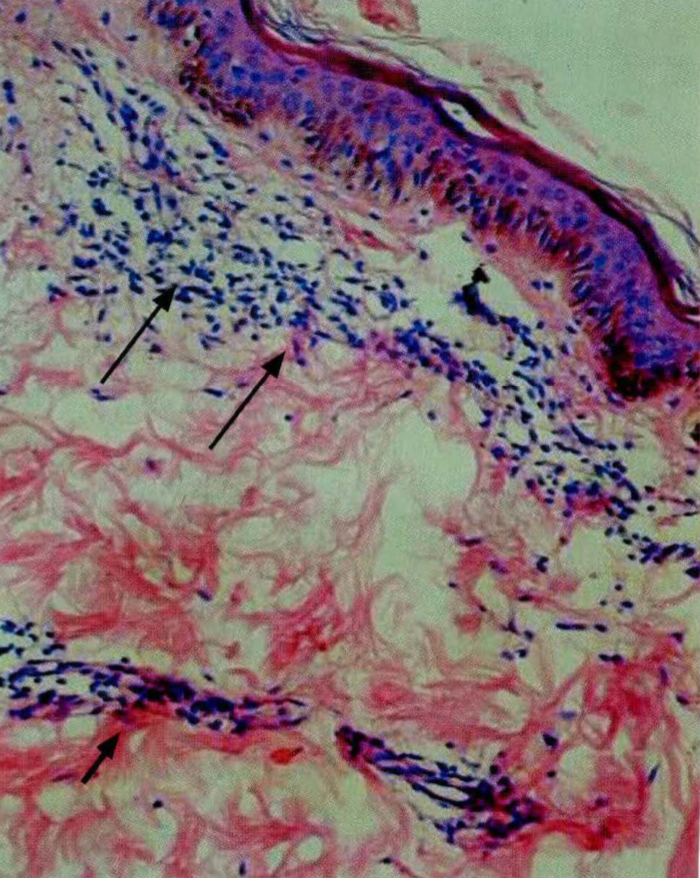
El Mycobacterium leprae, agente causal de la lepra o enfermedad de Hansen, es un bacilo ácidoalcohol resistente de muy lenta replicación, con características muy especiales en su estructura, las cuales son responsables de varias de las respuestas inmunológicas presentadas por el huésped. Se cree que la vía de entrada del bacilo es a través de secreciones nasales y orales, para luego diseminarse e invadir el tejido nervioso por el cual presenta un tropismo especial. Una vez se desarrolla la enfermedad, diferentes factores, entre los cuales se encuentran los genéticos, hacen que las manifestaciones clínicas, inmunológicas y patológicas varíen de paciente a paciente, en un espectro que va desde el polo tuberculoide hasta el polo lepromatoso. En el polo tuberculoide, la respuesta de inmunidad celular del tipo Th 1 logra erradicar de manera eficiente la infección pero ocasiona daño tisular importante. En el polo lepromatoso, la respuesta celular Th 1 es inefectiva, predominando la inmunidad humoral y la inadecuada destrucción del agente causal. El espectro de la enfermedad es dinámico, lo cual permite el desarrollo de los estados reaccionales de tipo I, tipo II y tipo III, los cuales empeoran los síntomas cutáneos y neurales y entorpecen la recuperación clínica del paciente. Los tratamientos para las reacciones buscan frenar esta exagerada respuesta inmunológica, y los esteroides y la talidomida son los medicamentos utilizados por excelencia. Se necesitan más investigaciones para una mejor comprensión del comportamiento inmunológico y patológico de la infección por el bacilo de Hansen.
Biografía del autor/a
Adriana Cruz A
RII Dermatología, Universidad del Valle, Cali.
Referencias bibliográficas
Camargo D, Orozco LC. En: Rodríguez G, Orozco LC. Lepra. Instituto Nacional de Salud, Santafé de Bogotá 1996:19-25.
Gelber RH, Rea TH. Mycobacterium leprae (Leprosy, Hansen's Disease). En: Mandell GL, Bennett JE, Dolin R. Principies and Practice of lnfectious Diseases, Churchill Livingstone. 2000: 2608-2614.
Hunter SW, Fujiwara T, Brennan PJ. Structure and antigenicity of the major specific glycolipid antigen of Mycobacterium leprae. J Biol Chem 1982; 257:15072-15078.
Klebanoff SJ, Shepard CC. Toxic effect of the peroxidase-hydrogen peroxide-halide antimicrobial system on Mycobacterium leprae. lnfect Immun 1984; 44:534-536.
Abulafia J, Vignale RA. Leprosy: accessory immune system as effector of infectious, metabolic, and immunologic reactions. Int J Dermatol 2001; 40:673-687.
https://doi.org/10.1046/j.1365-4362.2001.01259.x
Dawlah ZM, Cabrera A, Ahern K, et al. A phase 2 open trial of pentoxyfilline for the treatment of leprosy reactions. Int J Lepr Other Mycobact Dis 2002; 38-43.
Davey T F, Rees RJ. T he nasal discharge in leprosy: clinical and bacteriological aspects. Lepr Rev 1974; 45:121-134.
https://doi.org/10.5935/0305-7518.19740014
Sarmiento C. Clasificación. En: Rodríguez G, Orozco LC. Lepra 1996:48-50.
Van Eden W, González NM, De Vries RR, et al. HLA-linked control of predisposition to lepromatous leprosy. J Infect Dis 1985; 151:9-14.
https://doi.org/10.1093/infdis/151.1.9
Abulafia J, Vignale RA. Leprosy: pathogenesis updated. Int J Dermatol 1999; 38:321-334.
https://doi.org/10.1046/j.1365-4362.1999.00650.x
Roy S, McGuire W, Mascie-Taylor CG, et al. Tumor necrosis factor promoter polymorphism and susceptibility to lepromatous leprosy. J lnfect Dis 1997; 176:530-532.
https://doi.org/10.1086/517282
Knight JC, Kwiatkowski D. Inherited variability of tumor necrosis factor production and susceptibility to infectious disease. Proc Assoc Am Phys 1999; 111:290-298.
https://doi.org/10.1046/j.1525-1381.1999.99237.x
Sarno EN, Santos AR , Jardim MR, et al. Pathogenesis of nerve damage in leprosy: genetic polymorphism regulates the production of TNF alpha. Lepr Rev 2000; 71: S15-158-160.
https://doi.org/10.5935/0305-7518.20000087
Camargo D. Inmunología. En: Rodríguez G, Orozco LC. Lepra 1996:35-47.
Sieling PA, Wang XH, Gately MK, et al. IL-12 regulates T helper type 1 cytokine responses in human infectious disease. J Immunol 1994; 153:3639-3647.
Abbas AK, Lichtman AH, Pober JS. Inmunología Celular y Molecular, McGraw-Hill 2000; 13:303.
Modlin RL, Rea TH. lmmunology of leprosy granulomas. Springer Semin Immunopathol. 1998; 10:359-374.
https://doi.org/10.1007/BF02053846
Moubasher AD, Kamel NA, Zedan H, et al. Cytokines in leprosy. I. Serum cytokine profile in leprosy. Int J Dermatol 1998; 37: 733-740.
https://doi.org/10.1046/j.1365-4362.1998.00381.x
Rea TH, Modlin RL. Leprosy. En: Freedberg IM, Eisen AZ, Wolff K, et.al. Dermatology in General Medicine, McGraw-Hill 1999:2306-2317.
Buchanan TM. Serology of leprosy. En: Hastings RC. Leprosy. New York, Churchill Livingstone 1994:157.
Rodríguez G. Estados reccionales. En: Rodríguez G, Orozco LC. Lepra 1996:129-142.
Moraes MO, Sampaio EP, Nery JA, et al. Sequential erythema nodosum leprosum and reversal reaction with similar lesional cytokine mRNA patterns in a borderline leprosy patient. Br J Dermatol 2001; 144:175-181.
https://doi.org/10.1046/j.1365-2133.2001.03970.x
Sreenivasan P, Misra RS, Wilfred D, et al. Lepromatous leprosy patients show T helper1-like cytokine profile with differential expression of interleukin-10 during type 1 and 2 reactions. lmmunology 1998; 95:529-536.
https://doi.org/10.1046/j.1365-2567.1998.00634.x
Manandhar R, Shrestha N, Butlin CR, et al. High levels of inflammatory cytoquines are associated with poor clinical response to steroid treatment and recurrent episodes of type 1 reactions in leprosy. Clin Exp Immunol 2002; 128:333-338.
https://doi.org/10.1046/j.1365-2249.2002.01791.x
Moraes MO,Sarno EM,Teles RM,et al.Anti-inflammatory drugs block cytokine mRNA accumulation in the skin and improve the clinical condition of reactional leprosy patients. J lnvest Dermatol 2000; 115:935-941.
https://doi.org/10.1046/j.1523-1747.2000.00158.x
Schon T. Hernandez-Pando RH, Negesse Y, et al. Expression of inducible nitric oxide synthase and nitrotyrosine in borderline leprosy lesions. Brit J Dermatol. 2001; 145:809-815.
https://doi.org/10.1046/j.1365-2133.2001.04491.x
Schon T, Leekassa R, Gebre N, et al. High dose prednisolone treatment of leprosy patients undergoing reactions is associated with a rapid decrease in urinary nitric oxide metabolites and clinical improvement. Lepr Rev 2000; 71:355-362.
https://doi.org/10.5935/0305-7518.20000040
Moubasher AD, Kamel NA, Zedan H, et al. Cytokines in leprosy, II. Effect of treatment on serum cytokines in leprosy. Int J Dermatol 1998; 37:741-746.
https://doi.org/10.1046/j.1365-4362.1998.00382.x
Manandhar R, Le Master JW, Roche PW. Risk factors for erythema nodosum leprosum. Int J Lepr Other Mycobact Dis 1999; 67:270-278.
Nath I, Vemuri N, Reddi AL. Dysregulation of IL-4 expression in lepromatous leprosy patients with and without erythema nodosum leprosum. Lpre Rev 2000; 71:S130-137.
https://doi.org/10.5935/0305-7518.20000084
Goulart IM, Mineo JR, Foss NT. Production of transforming growth factor-beta 1 (T GF-beta 1) by blood monocytes from patients with different clinical forms of leprosy. Clin Exp Immunol. 2000; 122:330-334.
https://doi.org/10.1046/j.1365-2249.2000.01376.x
Rnadad JP, Faucher JP, Huerre JF. Diffuse lepromatous leprosy disclosed by cutaneous vasculitis. The Lucio phenomenon. Am Dermatol Venereol 1996; 123:21-23.
Saul A, Novales J. Lucio-Latapi leprosy and the Lucio phenomenon. Acta Leprol. 1983; 1:115-132.
Sarmiento C, Orozco LC. Tratamiento. En: Rodríguez G, Orozco LC. Lepra 1996:151-165.
Arbiser JL, Moschella SL. Clofazimine: a review of its medical uses and mechanisms of action. J Am Acad Dermatol. 1995; 32: 241-247
https://doi.org/10.1016/0190-9622(95)90134-5
Sheskin J. The treatment of lepra reaction in lepromatous leprosy. Fifteen years' experience with thalidomide. Int J Dermatol. 1980; 19:318-322.
https://doi.org/10.1111/j.1365-4362.1980.tb00342.x
Radomsky CL, Levine N. Thalidomide. Dermatol Clin 2001; 19:87-103.
https://doi.org/10.1016/S0733-8635(05)70232-1
LaDuca JR, Gaspari AA. Targeting tumor necrosis factor alpha. New drugs used to modulate inflammatory diseases. Dermatol Clin 2001; 19:617-635.
https://doi.org/10.1016/S0733-8635(05)70304-1
Shannon EJ, Miranda RO, Morales MJ, et al. lnhibition of de novo IgM antibody synthesis by thalidomide as a relevant mechanism of action in leprosy. Scand J Immunol. 1981; 13:553-562.
https://doi.org/10.1111/j.1365-3083.1981.tb00169.x
Bruynzeel I, Stoff TJ, Willinze R. Pentoxifylline and skin inflammation. Clin Exp Dermatol. 1998; 23:168-172.
https://doi.org/10.1046/j.1365-2230.1998.00316.x
Sampaio EP, Moraes MO, Nery JA, et al. Pentoxifylline decreases in vivo and in vitro tumor necrosis factor alpha production in lepromatous leprosy patients with erythema nodosum leprosum. Clin Exp Immunol 1998; 111 :300-308.
https://doi.org/10.1046/j.1365-2249.1998.00510.x
Nery JA, Perisse AR, Sales AM, et al. The use of pentoxifylline in the treatment of type 2 reactional episodes in leprosy. Indian J Lepr 2000; 72:457-467.
Sarna EN, Nery JA, García CC, et al. Is pentoxifylline a viable alternative in the treatment of ENL?. lnt J Lepr Other Mycobact Dis 1995; 63:570-571.
Park E, Schuller-Levis G, Park SY. Pentoxyfylline downregulates nitric oxide and tumor necrosis factor alpha induced by mycobacterial lipoarabinomannan in a macrophage cell line. Int J Lepr Other Mycobact Dis 2001; 69:225-233.
Oliveiro W, Gómez M, Mancias C, et al. A new therapeutic approach to type II leprosy reaction. lnt J Dermatol 1999; 38:931-933.
Cómo citar
Descargas
Descargas
Publicado
Cómo citar
Número
Sección
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |