Lo que debe saber el dermatólogo sobre los medicamentos biológicos y los biosimilares
Palabras clave:
biológicos, biosimilares, reglamentaciónResumen
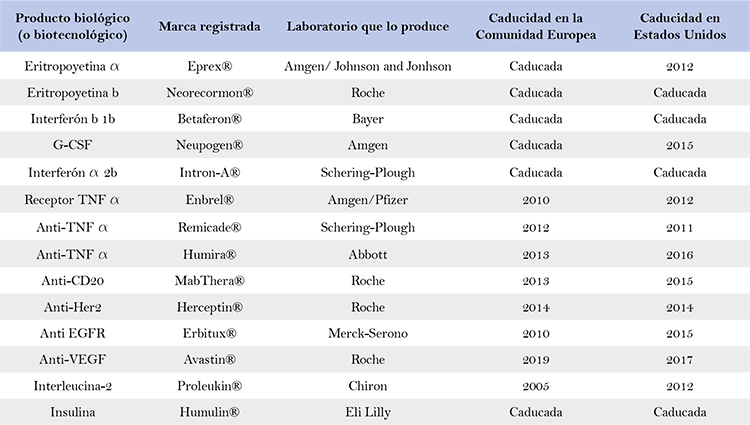
Los medicamentos biológicos se han convertido en los últimos años en una de las principales alternativas para el tratamiento de diversas enfermedades graves y su uso futuro en otras enfermedades es aún más prometedor. A pesar de que estos productos son un arsenal terapéutico importante y novedoso, su costo de producción y desarrollo ha limitado su acceso a los pacientes, especialmente en los países en desarrollo. Por tal motivo, en la última década, y en respuesta a la caducidad de las patentes de diferentes biológicos en el mundo, se ha propiciado la introducción al mercado farmacéutico de lo que hoy se denominan biosimilares.
Teniendo en consideración que cada vez es mayor la introducción de los fármacos biosimilares en el arsenal terapéutico dermatológico, en este artículo de revisión se describe el proceso de producción de un producto biológico y las características que lo diferencian de uno biosimilar; además, se exponen algunos aspectos de la reglamentación mundial y local de estos productos.
Biografía del autor/a
Gloria Sanclemente
Médica dermatóloga, M.Sc. en Epidemióloga Clínica, candidata a Ph.D., Universidad Autónoma de Barcelona, España; Grupo Cochrane Iberoamericano, España; coordinadora, Grupo de Investigación Dermatológica; profesora asociada, Facultad de Medicina, Universidad de Antioquia Medellín, Colombia
Referencias bibliográficas
2. United States Patent and Trademark Office. Patents. Washington, USA, 2010. Fecha de consulta: 4 de marzo de 2011. Disponible en: http://www.uspto.gov/patents/resources/terms/156.jsp.
3. Wikipedia. The free Encyclopedia. List of best selling drugs. USA, 2010. Fecha de consulta: 7 de marzo de 2011. Disponible en: http://en.wikipedia.org/wiki/List_of_bestselling_drugs.
4. Redford H. The same but different. Nature. 2007;449:274-6.
5. Schellekens H. When biotech proteins go off-patent. Trends Biotechnol. 2004:22:406-10.
6. Calvo B, Zúñiga L. Medicamentos biotecnológicos: requisitos exigidos para el desarrollo y aprobación de biosimilares. Información Tecnológica. 2010;21:125-32.
7. Amgen Inc. Recombinant DNA technology. Canada, 2011. Fecha de consulta: 7 de marzo de 2011. Disponible en: en:http://www.amgen.ca/english/science/about_biotechnology_recombinant_dna_technology.html.
8. Schellekens H. Biosimilar therapeutics –What do we need to consider? NDT Plus. 2009;2:i27-36.
9. Roger SD. Biosimilars: How similar or dissimilar they are. Nephrology. 2006;11:341-6.
10. Karpusas M, Whitty A, Runkel L, Hochman P. The structure of human interferon-beta: Implications for activity. Cell Mol Life Sci. 1998;54:1203-16.
11. Nowicki M. Basic facts about biosimilars. Kidney Blood Press Res. 2007;30:267-72.
12. Schellkens H. Follow-on biologics: Challenges of the “next” generation. Nephrol Dial Transplant. 2005;20:iv31-6.
13. EMEA/H/C/000585. Refusal assessment report for Alpheon E. London, UK. 2006. Fecha de consulta: 4 de marzo de 2011. Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/000585/WC500070792.pdf.
14. Lazcano-Ponce E, Salazar-Martínez E, Gutiérrez-Castrellón P, Ángeles-Llerenas A, Hernández-Garduño, Viramontes JL. Ensayos clínicos aleatorizados: variantes, métodos de aleatorización, análisis, consideraciones éticas y regulación. Salud Pública de México. 2004;46: 559-84.
15. Friedman LM, Furberg CD, De Mets DL. Fundamentals of clinical trials. Fourth edition. New York, USA: Springer; 2010.
16. EMEA/CHMP/437/04. Guideline on similar biological medicinal products. Fecha de consulta: 4 de marzo de 2011. Disponible en: http://www.emea.europa.eu/(2005).
17. EMEA/CHMP/BWP/49348/05. Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substances: Quality issues (CHMP adopted February 2006). Fecha de consulta: 4 de marzo de 2011. Disponible en: http://www.emea.europa.eu/(2006).
18. EMEA/CHMP/42832/05. Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substances: Non clinical and clinical issues (CHMP adopted February 2006). Fecha de consulta: 4 de marzo de 2011. Disponible en: http://www.emea.europa.eu/(2006).
19. Wiecek A, Mikhail A. European regulatory guidelines for biosimilars. Nephrol Dial Transplant. 2006;21:v17-20.
20. EMEA/CHMP/94528/05. Annex guideline on similar biological medicinal products containing biotechnology-derived proteins as active substances: Non clinical and clinical issues –Guidances on similar medicinal products containing Somatropin (CHMP adopted February 2006). Fecha de consulta: 4 de marzo de 2011. Disponible en: http://www.emea.europa.eu/(2006).
21. EMEA/CHMP/94526/05. Annex guideline on similar biological medicinal products containing biotechnology-derived proteins as active substances: Non clinical and clinical issues –Guidances on similar medicinal products containing recombinant erythropoietins (CHMP adopted March 2006). Fecha de consulta: 4 de marzo de 2011. Disponible en: http://www.emea.europa.eu/(2006).
22. EMEA/CHMP/31329/05. Annex guideline on similar biological medicinal products containing biotechnologyderived proteins as active substances: Non clinical and clinical issues –Guidances on similar medicinal products containing recombinant granulocyte-colony stimulating factor (CHMP adopted February 2006). Fecha de consulta: 4 de marzo de 2011. Disponible en: http://www.emea.europa.eu/(2006).
23. ORDEN SCO/2874/2007 de 28 septiembre, por la que se establecen los medicamentos que constituyen excepción a la posible sustitución por el farmacéutico con arreglo al artículo 86.4 de la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios (BOE núm. 239, de 5 octubre [RCL 2007, 1818]) Fecha de consulta: 4 de marzo de 2011. Disponible en: http://www.aemps.es/actividad/legislacion/espana/docs/rcl_2007_1818-2009-1.pdf.
24. Chu R, Pugatch M. Biogenerics or biosimilars: Discussing the present, considering the future. Stockholm, 2009. Fecha de consulta: 4 de marzo de 2011. Disponible en: http://www.stockholm-network.org/downloads/publications/Biosimilars_FINAL.pdf.
25. Patent Docs. Clinical Trials are top issue at FDA hearings on biosimilars. USA, 2010. Fecha de consulta: 4 de marzo de 2011. Disponible en: http://www.patentdocs.org/2010/11/clinical-trial-requirements-are-top-issue-at-fda-hearings-onbiosimilars.html.
26. Caicedo L. Biosimilares: otro reto de la medicina del futuro. Bogotá, Colombia, 2007. Fecha de consulta: 4 de marzo de 2011. Disponible en: http://www.biofarmacos.org/files/contenido/Biosimilares%20otro%20reto%20de%20la%20medicina%20del%20futuro.pdf.
27. Colprensa. Colombia avanza en la reglamentación de medicamentos biotecnológicos. Cartagena, Colombia 2011. Fecha de consulta: 4 de abril de 2011. Disponible en: http://www.eluniversal.com.co/cartagena/vida-sana/colombia-avanza-enla-reglamentacion-de-medicamentos-biotecnologicos-18642.
Cómo citar
Descargas
Descargas
Publicado
Cómo citar
Número
Sección
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |