Grandes dosis de corticoides sistémicos en pacientes con síndrome de Stevens-Johnson y necrólisis epidérmica tóxica: descripción de siete casos y revisión de la literatura
Palabras clave:
síndrome de Stevens-Johnson, necrólisis epidérmica toxica, corticoides, erupciones cutáneasResumen
Antecedentes: El síndrome de Stevens-Johnson y la necrólisis epidérmica tóxica hacen parte del espectro de reacciones medicamentosas graves caracterizadas por una destrucción progresiva de la piel y las mucosas, y que son mediadas por una respuesta inmunitaria exagerada. A pesar de los múltiples avances en el entendimiento de su fisiopatología, no existe un tratamiento farmacológico que tenga suficiente evidencia clínica como para respaldar su uso de manera rutinaria. No obstante, a través de los años, varios investigadores han utilizado esteroides, con diferentes resultados. El objetivo del presente trabajo fue describir nuestra experiencia con el uso de esteroides en dosis grandes, para el manejo del síndrome de Stevens-Johnson y la necrólisis epidérmica tóxica.
Materiales y métodos: Se revisaron las historias clínicas de todos los pacientes mayores de 18 años que ingresaron a la Fundación Valle Lili (Cali, Colombia) con diagnóstico de síndrome de Stevens-Johnson o necrólisis epidérmica tóxica, entre el 1 de enero de 2006 y el 31 de mayo de 2010. Se registraron datos clínicos, epidemiológicos y resultados de pruebas de laboratorio solicitados a su ingreso al servicio de urgencias; se excluyeron los pacientes con un tiempo mayor de 10 días, desde el inicio de los síntomas hasta su ingreso a la institución.
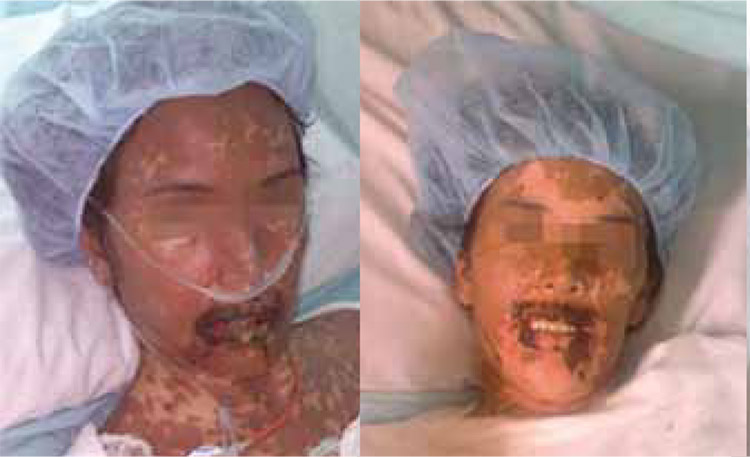
Resultados: Se incluyeron siete pacientes, con una edad promedio de 44 años (rango, 27 a 56 años), de los cuales, cinco eran mujeres; se registraron seis casos del síndrome de Stevens-Johnson y uno de necrólisis epidérmica tóxica. La mayoría de los pacientes presentaron una reacción cutánea generalizada, uno presentó un importante compromiso de las mucosas exclusivamente. En promedio, los esteroides se iniciaron 4,4 días después del inicio de los síntomas, con una duración del tratamiento de 3,7 días (rango, 3 a 5 días) y una estancia hospitalaria total promedio de 10,2 días (rango,4 a 19 días). El efecto secundario más común fue hipopotasiemia leve (6 de los 7 pacientes); una paciente presentó hiperglucemia, que requirió manejo con insulina, y bradicardia asociada al uso de metilprednisolona al tercer día de iniciado el tratamiento. Dos pacientes presentaron sepsis sin aislamiento del germen, lo que conllevó a una mayor estancia hospitalaria en uno de ellos.
Conclusión: En nuestra serie de pacientes, el uso de grandes dosis de esteroides se asoció a una rápida resolución de las manifestaciones cutáneas, teniendo como efecto secundario más frecuente la hipopotasiemia leve que mejoró de forma adecuada con la reposición.
Biografía del autor/a
Juan Carlos Díaz
Servicio de Medicina Interna, Fundación Valle del Lili, Cali, Colombia
Diego Bonilla
Servicio de Medicina Interna, Fundación Valle del Lili, Cali, Colombia
Ana Francisca Ramírez
Servicio de Dermatología, Fundación Valle del Lili, Cali, Colombia
Melba Cristina Herrera
Servicio de Dermatología, Fundación Valle del Lili, Cali, Colombia
Luis Fernando Ramírez
Servicio de Medicina Interna, Fundación Valle del Lili, Cali, Colombia
Carlos Daniel Serrano
Servicio de Medicina Interna, Fundación Valle del Lili, Cali, Colombia
Unidad de Alergia, Fundación Valle del Lili, Cali, Colombia
Referencias bibliográficas
2. Inachi S, Mizutani H, Shimizu M. Epidermal apoptotic cell death in erythema multiforme and Stevens-Johnson syndrome. Arch Dermatol. 1997;133:845-9.
3. Miyauchi H, Losokawa H, Akaeda T, Iba H, Asada Y. et al. Tcell subsets in drug-induced toxic epidermal necrolysis. Arch DermatoI. 1991;127:851-5.
4. Abe R, Shimizu T, Shibaki A, Nakamura H, Watanabe H, Shimizu H. Toxic epidermal necrolysis and Stevens-Johnson syndrome are induced by soluble Fas ligand. Am J Pathol. 2003;162:1515-20.
5. Caproni M, Torchia D, Schincaglia E, Volpi W, Frezzolini A, Schena D et al. Expression of cytokines and chemokine receptors in the cutaneous lesions of erythema multiforme and Stevens-Johnson syndrome –toxic epidermal necrolysis. Br J Dermatol. 2006;155:722-8.
6. Roujeau JC, Stern RS. Severe adverse cutaneous reactions to drugs. N Engl J Med. 1994;331:1272-85.
7. Patterson R, Tripathi A. Stevens-Johnson syndrome: Getting ready for the year 2000 and beyond. Ann All Asthma Immunol. 1999;83:339-40.
8. Beltrani VS. Counterpoint to the use of systemic corticosteroids in the Stevens-Johnson syndrome. Ann Allergy Asthma Immunol. 2000;85:422-3.
9. Charlesworth E. Counterpoint to the use of systemic corticosteroids in the Stevens-Johnson syndrome. Ann Allergy Asthma Immunol. 2000;85:422-3.
10. Halebian PH, Corder VJ, Madden MR, Finklestein JL, Shires GT. Improved burn center survival of patients with toxic epidermal necrolysis managed without corticosteroids. Ann Surg. 1986;204:512-3.
11. Paul C, Wolkenstein P, Adle H, Wechsler J, Garchon HJ, Revus J et al. Apoptosis as a mechanism of keratinocyte death in toxic epidermal necrolysis. Br J Dermatol. 1996;134:710-4.
12. Kardaun S, Jonkman M. Dexamethasone pulse therapy for Stevens-Johnson Syndrome/toxic epidermal necrolysis. Acta Derm Venereol. 2007;87:144-8.
13. Yamane Y, Aihara M, Ikezawa Z. Analysis of Stevens-Johnson syndrome and toxic epidermal necrolysis in Japan from 2000 to 2006. Allergol Int. 2007;56:419-25.
14. Tripathi A, Ditto A, Grammer L, Greenberger P, McGrath K, Zeiss R, et al. Corticosteroid therapy in an additional 13 cases of Stevens-Johnson syndrome: A total series of 67 cases. Allergy and Asthma Proc. 2000;21:101-5.
15. Araki Y, Sotozono C, Inatomi T, Ueta M, Yokoi N, Ueda E, et al. Successful treatment of Stevens-Johnson syndrome with steroid pulse therapy at disease onset. Am J Ophthalmol. 2009;147:1004-11.
16. Yang Y, Xu J, Li F, Zhu X. Combination therapy of intravenous immunoglobulin and corticosteroid in the treatment of toxic epidermal necrolysis and Stevens-Johnson syndrome: A retrospective comparative study in China. Int J Dermatol. 2009;481122-8.
17. Schneck J, Fagot JP, Sekula P, Sassolas B, Roujeau JC, Mockenhaupt M. Effects of treatments on the mortality of Stevens-Johnson syndrome and toxic epidermal necrolysis: A retrospective study on patients included in the prospective EuroSCAR Study. J Am Acad Dermatol. 2008;58:33-40.
18. Kakourou T, Klontza D, Soteropoulou F, Kattamis C. Corticosteroid treatment of erythema multiforme major (StevensJohnson syndrome) in children. Eur J Pediatr. 1997;156:90-3.
19. Halevy S, Ghislain PD, Mockenhaupt M, Fagot JP, Bouwes Bavinck JN, Sidoroff A, Naldi L, Dunant A, Viboud C, Roujeau JC; EuroSCAR Study Group. Allopurinol is the most common cause of Stevens-Johnson syndrome and toxic epidermal necrolysis in Europe and Israel. J Am Acad Dermatol. 2008;58:25-32.
20. Hung SI, Chung WH, Liou LB, Chu CC, Lin M, Huang HP, et al. HLA-B*5801 allele as a genetic marker for severe cutaneous adverse reactions caused by allopurinol. Proc Natl Acad Sci USA. 2005;102:4134-9.
21. van der Meer J, Schuttelaar M, Toth G, Kardaun S, Beerthuizen G, de Jong M, et al. Successful dexamethasone pulse therapy in a toxic epidermal necrolysis (TEN) patient featuring recurrent TEN to oxazepam. Clin and Exp Derm. 2001;26:654-6.
22. Paice BJ, Paterson KR, Onyanga-Omara F, Donnelly T, Gray JMB, Lawson DH. Record linkage study of hypokalemia in hospitalized patients. Postgrad Med J. 1986;62:187-91.
23. Tvede N, Nielsen LP, Andersen V. Bradycardia after high-dose intravenous methylprednisolone therapy. Scand J Rheumatol. 1986;15:302-4.
24. Horeyseck G, Thämer V. Methylprednisolone-induced inhibition of the sympathetic vasomotor tonus in hemorrhagic shock. Chir Forum Exp Klin Forsch. 1978;65-8. (no tiene volume dejalo asi)
25. Guillén EL, Ruiz AM, Bugallo JB. Hypotension, bradycardia, and asystole after high-dose intravenous methylprednisolone in a monitored patient. Am J Kidney Dis. 1998;32:E4.
Cómo citar
Descargas
Descargas
Publicado
Cómo citar
Número
Sección
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |