Terapia biológica para psoriasis
Resumen
La psoriasis es considerada una enfermedad inflamatoria crónica, que afecta al paciente tanto en forma física como psicológica, para la que la mayoría de las terapias sistémicas existentes presentan toxicidad hepática renal o hematológica, como mopsalem y luz ultravioleta, metotrexate y ciclosporina, entre otros, lo que hace difícil el tratamiento a largo plazo. Con el desarrollo en las últimas décadas de la biología molecular y ciencias afines como la inmunología se han hecho evidentes los mecanismos inmunes en la patogénesis de la enfermedad y, por lo tanto, el desarrollo de medicamentos dirigidos contra las moléculas de adhesión, activación, migración de los linfocitos T y sus productos efectores, las citoquinas. Estos medicamentos se han elaborado con técnicas de biología molecular utilizando la clonación por medio de ADN recombinante.
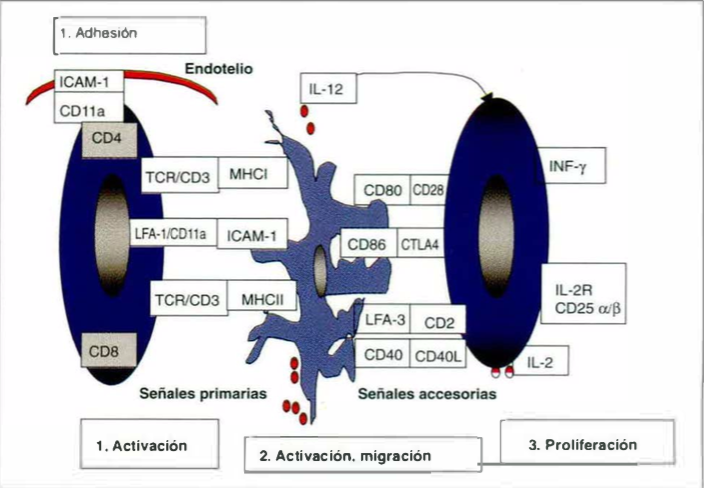
Cada paso inmunológico cuenta por lo menos con un intento de terapia para frenar la cascada inmunológica o para alterarla; ejemplos los constituyen anticuerpos monoclonales contra el receptor de células T, contra interleuquina 2 o su receptor, contra las moléculas de las señales primarias y las señales accesorias como el CD2, además de bloqueo de las citoquinas efectoras como el factor de necrosis tumoral alfa, interleuquina 8 e interferon gamma.
De éstos, la FDA ha aprobado el alefacept, anticuerpo monoclonal dirigido contra CD2; el infliximab, dirigido contra el factor de necrosis tumoral alfa {TNF-a), y muchos otros se encuentran en fase II o 111 de investigación. Aunque son medicamentos prometedores y esperanzadores, se debe estar atento a la aparición de efectos colaterales a largo plazo y conocer los ya descritos.
Biografía del autor/a
Lucy García Rodríguez, Universidad del Valle
Docente Dermatología, Universidad del Valle, Hospital Universitario del Valle.
Cómo citar
Descargas
Descargas
Publicado
Cómo citar
Número
Sección
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |