Síndrome de Stevens-Johnson y necrólisis epidérmica tóxica en el Hospital Universitario del Valle “Evaristo García” durante un periodo de 9 años
DOI:
https://doi.org/10.29176/2590843X.256Palabras clave:
síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, factor de necrosis tumoral alfa, pentoxifilinaResumen
La necrólisis epidérmica tóxica y el síndrome de Stevens-Johnson son las reacciones cutáneas a medicamentos de mayor gravedad y constituyen un espectro de la misma enfermedad, compartiendo aspectos etiológicos, patogénicos, histológicos y terapéuticos.
Objetivos. Describir los casos de necrólisis epidérmica tóxica y síndrome de Stevens-Johnson durante un periodo de nueve años en el Hospital Universitario del Valle, los tratamientos usados en el manejo de los pacientes y la mortalidad de los mismos.
Metodología. Se hizo una revisión retrospectiva de las historias clínicas de los pacientes con Stevens-Johnson y necrólisis epidérmica tóxica, diagnosticados y manejados desde febrero de 2003 hasta abril de 2012 en el Hospital Universitario del Valle. Se analizaron las características clínicas, frecuencia, mortalidad, medicamentos relacionados como posibles desencadenantes, tratamientos utilizados y sus resultados.
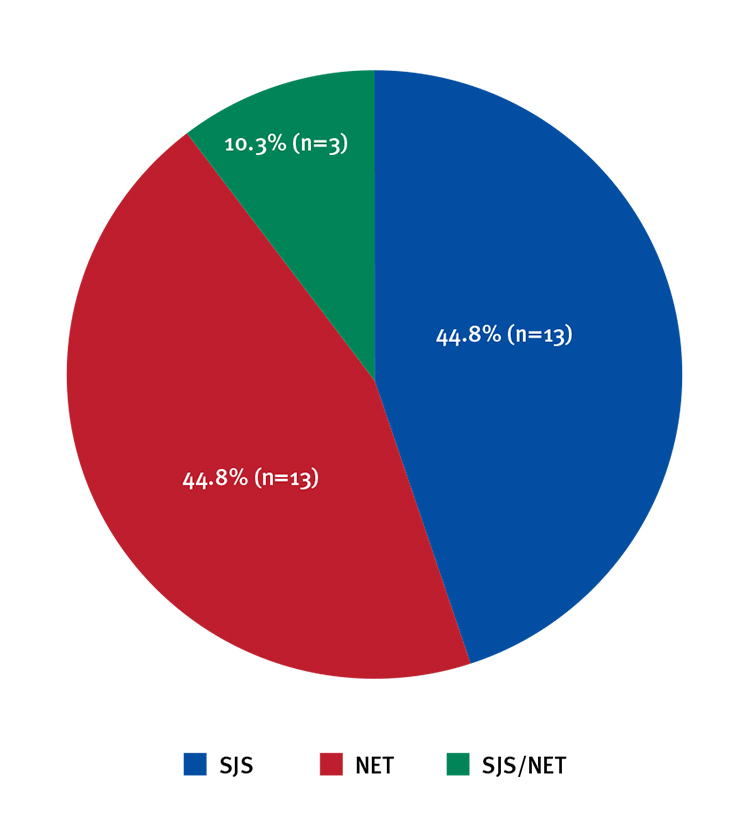
Resultados. Se analizaron los datos de 29 casos, 13 (44,8 %) tenían diagnóstico de necrólisis epidérmica tóxica, 13 (44,8 %) de síndrome de Stevens-Johnson y los tres restantes (10,3 %) síndrome de superposición de síndrome de StevensJohnson y necrólisis epidérmica tóxica. En el 55 % (n=16) se pudo establecer un solo medicamento como desencadenante. En 41 % (n=12) de los pacientes se encontraron dos o más medicamentos como posibles desencadenantes. Solo en uno no se identificó ningún medicamento. Los antibióticos, los anticonvulsivos, los AINE y el alopurinol fueron los más asociados. Todos los pacientes recibieron medidas de soporte. El 68 % (n=20) de los pacientes recibió tratamiento antibiótico debido a infección asociada. Veintitrés pacientes (79,3 %) recibieron pentoxifilina como parte de su tratamiento. Seis (20,6 %) recibieron gammaglobulina (dos de ellos asociada a pentoxifilina oral). La mortalidad fue del 3,4 % (n=1).
Conclusiones. Las medidas de soporte son fundamentales en el manejo de los pacientes con necrólisis epidérmica tóxica y síndrome de Stevens-Johnson, independientemente del área corporal comprometida, así como el manejo oportuno de complicaciones como la infección sobreagregada. La pentoxifilina puede considerarse una alternativa en el tratamiento de estas enfermedades.
Biografía del autor/a
David Andrés Arias
Médico, residente de Dermatología y Cirugía Dermatológica, Universidad del Valle, Cali, Colombia.
Paola Andrea Londoño
Médica dermatóloga, Universidad del Valle, Cali, Colombia.
Juana Gabriela López
Médica dermatóloga, Universidad del Valle, Cali, Colombia.
Luis Hernando Moreno
Médico dermatólogo, M.Sc. en Microbiología; jefe, Departamento de Dermatología y Cirugía Dermatológica, Universidad del Valle, Cali, Colombia
Referencias bibliográficas
2. García I, Roujeau JC, Cruces M. Necrólisis epidérmica tóxica y síndrome de Stevens-Johnson: clasificación y actualidad terapéutica. Actas Dermosifiliogr. 2000;91:541-51.
3. Criton S, Devi K, Sridevi RK, Asokan RU. Toxic epidermal necrolysis: A retrospective study. Int J Dermatol. 1997;36:923-5.
4. Knowles S, Sheir N. Clinical risk management of Stevens-Johnson syndrome/toxic epidermal necrolysis spectrum. Dermatol Ther. 2009;22:441-51.
5. Jean-AanKoh M, KwangTay Y. An update on Stevens-Johnson syndrome and toxic epidermal necrolysis in children. Curr Opin Pediatr. 2009;21:505-10.
6. 6. Akosa AB, Elhag AM. Toxic epidermal necrolysis. A study of the sweat glands. J Clin Pathol. 1995;22:359-64.
7. Ioannides D, Vakali G, Chrysomallis F, Chaidemenos G, Mpatsios K, Mourellou O, et al. Toxic epidermal necrolysis: A study of 22 cases. J Eur Acad Dermatol Venereol. 1994;3:266-75.
8. Weightman W. Toxic epidermal necrolysis. Australas J Dermatol. 1996;37;167-77.
9. Gerdts B, Vloemans AFPM, Kreis RW. Toxic epidermal necrolysis; 15 years experience in a Dutch burns centre. J Eur Acad Dermatol Venereol. 2007;21:781-8.
10. Chave TA, Mortimer NJ, Sladden MJ, Hall AP, Hutchinson PE. Toxic epidermal necrolysis: Current evidence, practical management and future directions. Br J Dermatol. 2005;153:241-53.
11. Lazarczyk M, Grzela T, Korczak-Kowalska G, Niderla J, Oldak M, Jozwiak J, et al. Pentoxifylline inhibits perforin-dependent natural cytotoxicity in vitro. Oncol Rep. 2002;9:423-6.
12. Correia O, Delgado L, Leal I, Campillo F, Fleming-Torrinha J. Increased interleukin 10, tumor necrosis factor α and interleukin 6 levels in blister fluid of toxic epidermal necrolysis. J Am Acad Dermatol 2002;47:58-62.
13. Parsons J. Toxic epidermal necrolysis. Int J Dermatol. 1992;31;749-68.
14. Tristani-Firouzi P, Petersen M, Saffle J, Morris S, Zone J. Treatment of toxic epidermal necrolysis with intravenous immunoglobulin in children. J Am Acad Dermatol. 2002;47:548-52.
15. Teo L, Tay YK, Liu TT, Kwok C. Stevens-Johnson syndrome and toxic epidermal necrolysis: Efficacy of intravenous immunoglobulin and a review of treatment options. Singapore Med J. 2009;50:29-33.
16. Bastuji-Garin S, Rzany B, Stern RS, Shear NH, Naldi L, Roujeau JC. Clinical classification of cases of toxic epidermal necrolysis, Stevens-Johnson syndrome, and erythema multiforme. Arch Dermatol 1993; 129: 92-6.
17. Chung WH, Hung SI, Yang JY, Su SC, Huang SP, Wei CY et al. Granulysin is a key mediator for disseminated keratinocyte death in Stevens–Johnson syndrome and toxic epidermal necrolysis. Nat Med.2008; 14:1343–50.
18. Posadas SJ, Padial A, Torres MJ, Mayorga C, Leyva L, Sanchez E, et al. Delayed reactions to drugs show levels of perforin, granzyme B, and Fas-L to be related to disease severity. J Allergy Clin Immunol. 2002;109:155–61.
19. 19. Schöpf E, Stühmer A, Rzany B, Victor N, Zentgraf R, Kapp JF. Toxic Epidermal Necrolysis and Stevens-Johnson Syndrome An Epidemiologic Study From West Germany. Arch Dermatol. 1991;127:839–42.
20. Letko E, Papaliodis DN, Papaliodis GN, Daoud YJ, Ahmed AR, Foster CS. Stevens-Johnson syndrome and toxic epidermal necrolysis: a review of the literature. Ann Allergy Asthma Immunol. 2005; 94:419-36.
21. Revuz J, Penso D, Roujeau JC, Guillaume JC, Payne CR, Wechsler J, et al. Toxic epidermal necrolysis. Clinical findings and prognosis factors in 87 patients. Arch Dermatol. 1987;123:1160–5.
22. Bastuji Garin S, Fouchard N, Bertoschi M, Roujeau JC, Revuz J, Wolkenstien P. SCORTEN: A severity-of-illness score for toxic epidermal necrolysis. J Invest Dermatol. 2000;115:149–53.
23. Guégan S, Bastuji-Garin S, Poszepczynska-Guigné E, Roujeau JC, Revuz J. Performance of the SCORTEN during the first five days of hospitalization to predict the prognosis of epidermal necrolysis. J Invest Dermatol 2006;126:272-6
24. Garcia-Doval I, LeCleach L, Bocquet H, Otero XL, Roujeau JC. Toxic epidermal necrolysis and Stevens-Johnson syndrome: does early withdrawal of causative drugs decrease the risk of death? Arch Dermatol. 2000;136:323—7.
25. Schneck J, Fagot JP, Sekula P, Sassolas B, Roujeau JC, Mockenhaupt M. Effects of treatments on the mortality of Stevens-Johnson syndrome and toxic epidermal necrolysis: A retrospective study on patients included in the prospective. EuroSCAR Study. J Am Acad Dermatol. 2008;58:33-40.
26. Redondo P., De Erenchun F.R., Iglesias M.E., Monedero P. Quintanilla E. Toxic epidermal necrolysis. Treatment with pentoxifylline. Br. J. Dermatol.1994; 130: 688-9.
27. Sanclemente G., De la Roche C.A., Escobar C.E., Falabella R. Pentoxifylline in toxic epidermal necrolysis and Stevens-Johnson syndrome. Int. J. Dermatol., 38: 878-9, 1999.
28. Victoria J, Hormaza X. Pentoxifilina en enfermedades catastróficas en niños. Dermatol Pediatr Lat. 2004;2:21-6.
29. Samlaska CP, Winfield EA. Pentoxifylline. J Am Acad Dermatol. 1994;30:603-21.
30. French LE, Trent JT, Kerdel FA. Use of intravenous immunoglobulin in toxic epidermal necrolysis and Stevens-Johnson syndrome: Our current understanding. Int Immunopharmacol. 2006;6:543-9.
31. Prins C, Kerdel FA, Padilla RS, Hunziker T, Chimenti S, Viard I et al. Treatment of toxic epidermal necrolysis with high-dose intravenous immunoglobulins: multi-center retrospective analysis of 48 consecutive cases. Arch Dermatol 2003; 139: 26-32.
32. Halebian P. Improved burn center survival of patients with toxic epidermal necrolysis managed without corticosteroids. Ann Surg. 1986;204:503-12.
33. Roujeau JC, Stern RS. Severe adverse cutaneous reactions to drugs. N Engl J Med. 1994;331:1272-85.
34. Harr T, French LE. Toxic epidermal necrolysis and StevensJohnson syndrome. Orphanet J Rare Dis. 2010;16;39.
Cómo citar
Descargas
Descargas
Publicado
Cómo citar
Número
Sección
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |