Utilidad de la muestra de la lámina ungular en el diagnóstico de onicomicosis
Palabras clave:
diagnóstico, onicomicosis, lámina ungularResumen
Introducción. La sensibilidad de las pruebas convencionales (examen directo, cultivo) para el diagnóstico de la onicomicosis (25 a 80%), representa un problema para la decisión terapéutica del dermatólogo.
Objetivo. Determinar la exactitud diagnóstica de la muestra de la lámina ungular en pacientes con diagnóstico clínico de onicomicosis.
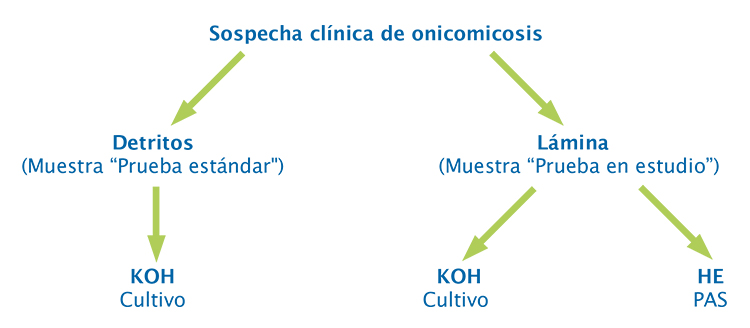
Metodología. Es un estudio prospectivo de pruebas diagnósticas en 50 pacientes con sospecha de onicomicosis. Se tomó muestra de la lámina ungular con cortaúñas estéril en el área de onicólisis para pruebas micológicas (KOHcultivo) y de histopatología (hematoxilina y eosina y ácido peryódico de Schiff), y muestra de detritos mediante raspado del lecho para prueba micológica. La toma de muestras y el procesamiento de las pruebas se realizaron en laboratorios de referencia y se interpretaron de manera ciega e independiente. La muestra de detritos se consideró la prueba estándar.
Resultados. Se observó compromiso de los pies en 90% de los pacientes, 86,6% con afectación del primer dedo. La prueba micológica de detritos fue positiva en 80% de los casos, encontrándose estructuras micóticas en el examen directo en 72% y aislamiento al cultivo en 64%. En la lámina ungular, la sensibilidad fue de 87,5% y la especificidad de 80%; el cociente de probabilidades positivo fue 4,4. Cinco muestras positivas con la tinción PAS fueron negativas en la prueba estándar. La sensibilidad neta aumentó a 95% mediante el análisis de las pruebas en paralelo de la lámina ungular. La mayoría de los aislamientos fueron especies de Candida (77,3% en detritos y 75,9% en la lámina ungular), y C. parapsilosis fue el aislamiento más frecuente.
Conclusión. Se propone la muestra de la lámina ungular para pruebas micológicas y tinción de PAS, como complemento a la muestra de detritos para el diagnóstico de onicomicosis.
Biografía del autor/a
Luz Marina Gómez
Médica dermatóloga; jefe, Servicio de Dermatología, Escuela de Ciencias de la Salud; coordinadora, Grupo de Investigación en Dermatología; profesora titular, Universidad Pontificia Bolivariana; dermatóloga, Clínica SOMA, Medellín, Colombia
Mónica Massaro
Médica, M.Sc. en Epidemiología; profesora asociada, Escuela de Ciencias de la Salud, Universidad Pontificia Bolivariana e Instituto Neurológico de Antioquia. Medellín, Colombia
Ángela María Tabares
Licenciada en Bacteriología y Laboratorio Clínico, Grupo de Micología Médica y Experimental, Corporación para Investigaciones Biológicas; Escuela de Microbiología, Universidad de Antioquia; Escuela de Ciencias de la Salud, Universidad Pontificia Bolivariana, Medellín, Colombia
Alejandra Zuluaga
Médica, microbióloga clínica, Grupo de Micología Médica y Experimental, Corporación para Investigaciones Biológicas; Escuela de Microbiología, Universidad de Antioquia; Escuela de Ciencias de la Salud, Universidad Pontificia Bolivariana, Medellín, Colombia
Juan David Vélez
Médico, Universidad Pontificia Bolivariana, Medellín, Colombia
Alejandro Vélez
Médico patólogo; docente, Escuela de Ciencias de la Salud, Universidad Pontificia Bolivariana; Hospital Pablo Tobón Uribe, Medellín, Colombia
Margarita Jaramillo
Bacterióloga, Laboratorio de Patología, Escuela de Ciencias de la Salud, Universidad Pontificia Bolivariana, Medellín, Colombia
Luz Elena Cano
Ph.D. en Inmunología, Grupo de Micología Médica y Experimental, Corporación para Investigaciones Biológicas; Escuela de Microbiología, Universidad de Antioquia; Escuela de Ciencias de la Salud, Universidad Pontificia Bolivariana, Medellín, Colombia
Referencias bibliográficas
2. Aberhasky RC. Laboratory diagnosis of onychomycosis. Clin Podiatr Med Surg. 2004;21:565-78.
3. Scher RK, Tavvakkol A, Bact D, Sigurgeirsson B, Hay RJ, Joseph WS, et al. J Am Acad Dermatol. 2007;56:939-44.
4. Weinberg JM, Koestenblatt EK, Tutrone WD, Tishler HR, Najarian L. Comparison of diagnostic methods in the evaluation of the onychomycosis. J Am Acad Dermatol. 2003;49:193-7.
5. Elewski BE. Clinical pearl: Diagnosis of onychomycosis. J Am Acad. 1995;32:500-1.
6. Lawry MA, Haneke E, Strobeck K, Martin S, Zummer B, Romano PS. Methods for diagnosing onychomycosis: A comparative study and review of the literature. Arch Dermatol. 2000;136:1112-6.
7. Borkowsky P, Williams M, Holewinsky J, Bakotic B. Onychomycosis: An analysis of 50 cases and comparison of diagnostic techniques. J Am Podiatr Med Assoc. 2001;7:351-5.
8. Zuluaga A, de Bedout C, Tabares A, Cano LE, Restrepo A, Arango M, et al. Comportamiento de los agentes etioló- gicos de las onicomicosis en un laboratorio de micología de referencia (Medellín 1994-2003). Med Cutan Iber Lat Am. 2005;33:251-6.
9. Escobar ML, Carmona-Fonseca J. Onychomycosis by common non-dermatophyte moulds. Rev Iberoam Micol. 2003;20:6-10.
10. Gupta A, Cooper E. Onychomycosis. J Am Acad Dermatol. 2009;117:2424.
11. Ellis DH. Diagnosis of onychomycosis made simple. J Am Acad Dermatol. 1999;40:S3-8.
12. Piérard GE, Arrese JE, De Doncker P, Piérar-Franchimonto C. Present and potential diagnosis techniques in onychomycosis. J Am Acad Dermatol. 1996;34:273-7.
13. De Berker D. Fungal nail disease. N Engl J Med. 2009;360:2108-16.
14. De Chauvin MF. New diagnostic techniques. J Eur Acad Dermatol Venereol. 2005;19(Suppl.1):20-4.
15. Elewski BE. Diagnostic techniques for confirming onychomycosis. J Am Acad Dermatol. 1996;35:S6-9.
16. Drake LA, Dinehart SM, Farmer ER, Goltz RW, Graham G, Hordinsky MK, et al. Guidelines of care for superficial mycotic infections of the skin: Onychomycosis. J Am Acad Dermatol. 1996;34:116-21.
17. Chang A, Wharton J, Tam S, Kovich O, Kamino H. A modified approach to the histologic diagnosis of onychomycosis. J Am Acad Dermatol. 2007;57:849-53.
18. Reisberger EM, Ables C, Landthaler M, Szlimics RM. Histophatological diagnosis of onychomycosis by periodic acidSchiff-stained nail clipping. Br J Dermatol. 2003;148:749-54.
19. Gianni C, Morelli V, Cerri A, Greco C, Rossini P, Guiducci A, et al. Usefulness of histological examination for the diagnosis of onychomycosis. Dermatology. 2001;202:283-8.
20. Lilly KK, Koshnick RL, Grill JP, Khalil ZM, Nelson DB, Warshaw EM. Cost-effectiveness of diagnostic tests for toenail onychomycosis: A repeated-measure, single-blinded, cross-sectional evaluation of 7 diagnostic tests. J Am Acad Dermatol. 2006;55:620-6.
21. Karimzadegan-Nia M, Mir-Amin-Mohammadi A, Bouzari N, Firooz A. Comparison of direct smear, culture and histology for the diagnosis of onychomycosis. Australas J Dermatol. 2007;48:18-21.
22. Suárez SM, Silvers DN, Scher RK, Pearlstein HH, Auerbach R. Histologic evaluation of nail clippings for diagnosing onychomycosis. Arch Dermatol. 1991;127:1517-9.
Cómo citar
Descargas
Descargas
Publicado
Cómo citar
Número
Sección
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |